Uno de los principales retos en la actualidad consiste en hacer frente al cambio climático. Este fenómeno es una realidad nada halagüeña. De acuerdo con informes expedidos por la ONU, la temperatura promedio de la superficie terrestre es, en la actualidad, 1.1 °C más elevada que a finales del siglo XIX. De hecho, la última década –de 2011 a 2020– ha sido la más cálida registrada hasta el momento.
No obstante, estos cambios en la temperatura han sido sólo una mínima fracción de lo que representa el concepto de cambio climático como tal. De hecho, se sabe que no iniciaron desde finales del siglo XIX, sino desde que comenzaron los adelantos tecnológicos generados a causa de la Revolución Industrial; es decir, poco antes de mediados del siglo XVIII. Con la quema de combustibles fósiles y con la industrialización subsecuente, se disparó la producción de gases de efecto invernadero, lo que ha tenido como consecuencia graves sequías, incendios forestales, escasez de agua, pérdida de la extensión de los glaciares, inundaciones, aumentos del nivel del mar, graves tormentas y pérdida de la biodiversidad.
Pero, más allá de las terribles consecuencias que el cambio climático pueda estar causando en los ecosistemas terrestres, quizás debamos ver hacia atrás, en la historia geológica de nuestro planeta, con el fin de indagar más sobre su pasado térmico. Y, ¿cómo llevamos eso a cabo? ¿Es posible, de alguna manera?
Sí lo es… y lo es gracias a los datos químicos –geoquímicos, con mayor exactitud– que podemos encontrar en los restos de algunos organismos. Estos remanentes biológicos fungen como archivos climatológicos; como una ventana que nos permite mirar hacia la historia de los cambios en las condiciones de temperatura, precipitación y productividad biológica de nuestro planeta, entre otras.
Proxies ambientales
Un proxy (plural proxies) es un indicador que nos aproxima al valor de una variable, en cualquier ámbito. En las ciencias de la Tierra, un proxy hace referencia a cualquier registro natural de cambio climático. Estos se pueden obtener de diversos tipos de muestras, como los anillos de los árboles, sedimentos, núcleos de hielo obtenido de los casquetes polares, y los restos de algunos organismos, como los huesos, dientes, conchas, exoesqueletos (como los de los corales, por ejemplo). Gracias a este tipo de muestras es que podemos reconstruir las mencionadas condiciones climáticas del pasado.
Quizás los proxies ambientales más conocidos son los isótopos. Existen dos tipos de isótopos (átomos del mismo elemento químico, pero con diferente masa atómica): los radioactivos y los estables. Los primeros se distinguen porque, con el paso del tiempo, se transforman en otro elemento químico a través del fenómeno conocido como decaimiento radioactivo. El ejemplo más conocido es el del carbono-14, que tiene una utilidad muy importante para determinar edades de yacimientos y muestras antiguas. Pero, sobre eso, se hablará en otra ocasión.
En el caso de los isótopos estables, los dos más sonados son los de carbono y oxígeno. Para el carbono, tenemos el carbono-12 (12C) y el carbono-13 (13C). El primero, más ligero, es el que nuestras moléculas y las reacciones metabólicas de todo ser vivo suelen “preferir”, a pesar de que ambos isótopos están presentes de manera natural. La proporción aproximada entre uno y otro es de 99 % a 1 %, en favor del 12C, con ciertas variaciones, de acuerdo con el sistema que se estudie.
Cuando en la historia de la Tierra se ha presentado una época de gran productividad biológica, estas proporciones suelen cambiar de manera notable. Por ejemplo, durante el periodo Carbonífero (hace unos 310 millones de años), gran parte del 12C disponible en la naturaleza se encontraba asimilado en los organismos (en sus moléculas constituyentes: proteínas, carbohidratos, lípidos, etc.). Por el contrario, el 13C se encontraba enriquecido, pero en la fracción inorgánica: sedimentos y rocas, principalmente. De esta manera es que podemos inferir cuándo la vida ha sufrido algún evento catastrófico. Por ejemplo, durante una de las cinco extinciones masivas (o seis, si se cuenta la del Antropoceno), el 12C, al no estar asimilado de manera tan abundante en los organismos, pasa a formar parte de la fracción inorgánica, con lo que la proporción de 13C contenido en esta disminuye ante el aumento del 12C. Entonces, la proporción 13C/12C (comúnmente llamada δ13C –delta carbono-13– en geoquímica) funge como un proxy de productividad biológica.
Por su parte, los isótopos estables del oxígeno son tres: 16O, 17O y 18O. El segundo, al ser sumamente escaso en la naturaleza, es poco utilizado con fines climatológicos. Por el contrario, 16O y 18O son los más abundantes (aproximadamente 99.75 % y 0.2 %, respectivamente) y, por ello, con este se suelen efectuar inferencias ambientales, principalmente en torno a la temperatura en el pasado. El 16O es el más ligero y abundante, razón por la cual es incorporado con mayor facilidad en toda molécula, tanto orgánica como inorgánica. Sin embargo, la temperatura tiene mucho que ver al momento de la distribución de los isótopos de oxígeno.
A grandes rasgos, se puede explicar de la siguiente manera: En épocas especialmente cálidas, como el Óptimo Climático Medieval (aproximadamente del año 1000 a 1200 de nuestra era), la tasa de evaporación fue mayor, lo que propició que el agua que se evaporaba del océano hacia la atmósfera incluyera átomos de ambos isótopos, 16O y 18O, prácticamente sin discriminación. Por el contrario, en una época fría, como la Pequeña Edad de Hielo (de 1300 a 1850 de nuestra era), la evaporación fomenta que el isótopo ligero (16O) fuera el que se evaporara con más facilidad, dejando al 18O en el agua del mar. Este 18O se incorpora entonces con mayor facilidad a las partes duras de los organismos –conchas, huesos, exoesqueletos, etc.–, así como también a los sedimentos que se terminan convirtiendo en rocas. Es por ello que una firma isotópica 18O/16O (o bien, δ18O) con valores más elevados indica temperaturas más bajas, y una firma con valores bajos temperaturas más altas. Es así como sabemos que en periodos como el Cretácico (hace de 135 a 66 millones de años), la temperatura de la superficie terrestre alcanzó una media ¡de 5 hasta 10 °C más que en la actualidad!
De manera similar, durante el intervalo entre el Paleoceno y el Eoceno (hace unos 55 millones de años), la temperatura fue incluso 13.6 °C más cálida que durante las últimas décadas del siglo XX. Adicionalmente, la concentración de CO2 en la atmósfera llegó a 1400 ppmv (partes por millón en volumen), valor que sobrepasa en más del triple al actual (cercano a las 420 ppmv), lo cual podría ayudar a explicar estas temperaturas en el pasado.
Además de la información sobre la temperatura del pasado, los isótopos de oxígeno nos pueden dar pistas sobre las precipitaciones y las variaciones de la salinidad en el pasado; todo ello con solamente un fragmento pulverizado de muestra.
De esta manera, hemos tenido una mirada hacia los climas en el pasado a través de la ventana que representa la paleoclimatología por medio de los isótopos de oxígeno. Y con ayuda de otros proxies, como los isótopos de carbono, ha sido posible determinar que muchas veces las extinciones están asociadas a crisis térmicas y ambientales. Esperemos que esto nos sirva como advertencia de que, de no cambiar ciertos hábitos como sociedad, podemos estarnos dirigiendo hacia nuestra extinción y la de tantas especies más.
Quizás falte mucho, pero la historia climática de la Tierra ha dado cuenta de ello.
Para saber más:
- Ramstein, G., Landais, A., Bouttes, N., Sepulchre, P., Govin, A. (2021): Paleoclimatology. Cham: Springer Nature, 478 pp.
- Stanley, S.M., Luczaj, J.A. (2014): Earth System History. New York: W.H. Freeman, 624 pp.
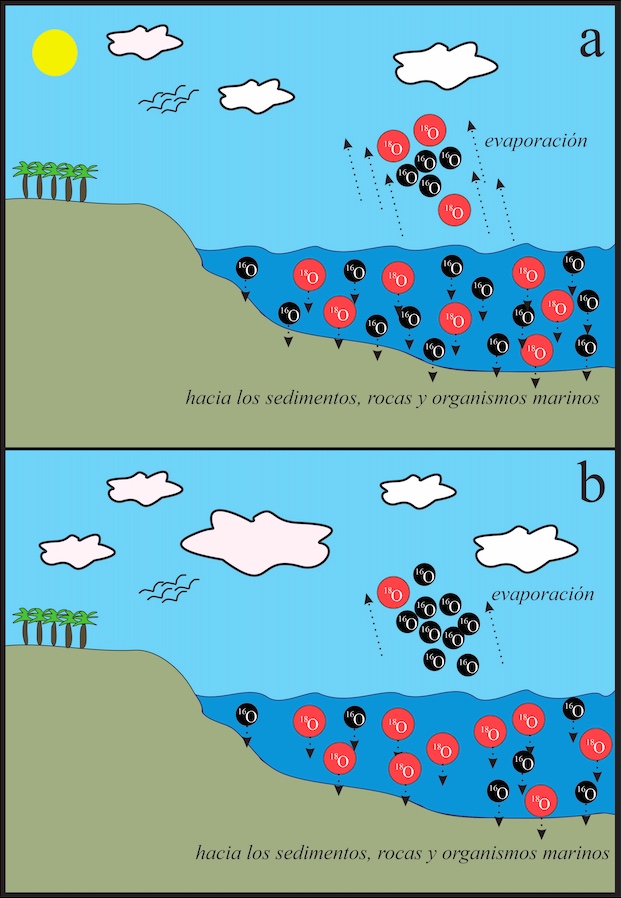
Figura 1.
- Condiciones climatológicas para la actualidad en una latitud templada. La temperatura de la superficie terrestre (alrededor de 15 °C) propicia que, tanto isótopos ligeros del oxígeno (16O, en negro) como los pesados (18O, en rojo), sean llevados a la atmósfera durante la evaporación del agua de los océanos. En estos, la proporción entre 16O y 18O es, por ende, “normal”.
- En este caso, al simular una época de menor evaporación, como lo sería una temporada fría (podría tratarse de una glaciación, en caso extremo) y en la misma latitud que en el inciso “a)”, existe una menor tasa de evaporación. Esto causa que los isótopos ligeros del oxígeno (16O) sean preferentemente desplazados a la atmósfera, en comparación con los más pesados (18O), lo que deriva en una proporción mayor de este último en las aguas oceánicas que con respecto al inciso “a)”. Esto, a su vez, aumenta la proporción de 18O en los sedimentos, las rocas y las conchas y huesos de los organismos que viven en el mar, con respecto a los que viven en una época más cálida.
*Imágenes ilustrativas. Ni el tamaño de los átomos, la cantidad de los mismos, ni la magnitud de la evaporación o de otros fenómenos se encuentran a escala.
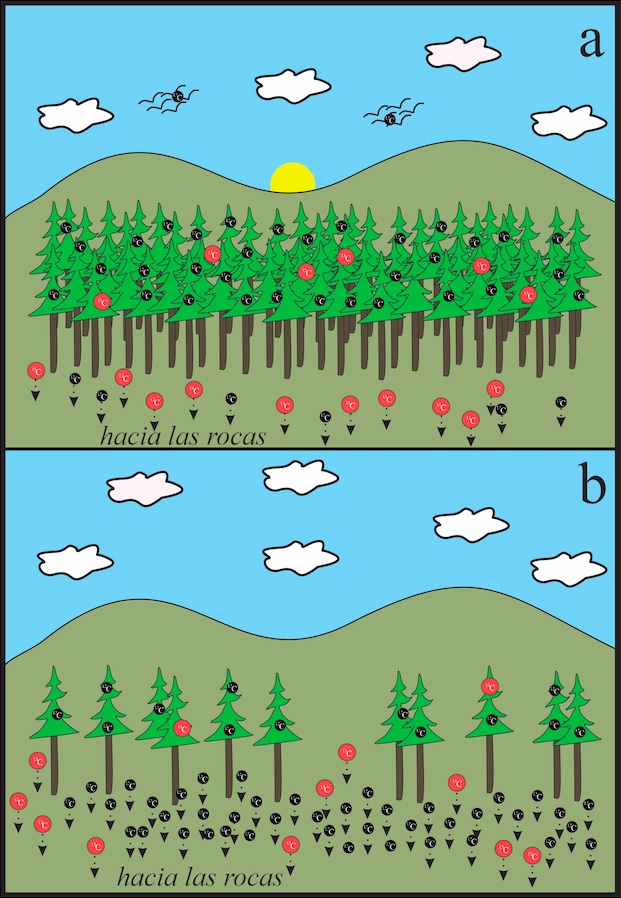
Figura 2.
- La Tierra durante una época de alta productividad biológica, como el periodo Carbonífero, hace 300 millones de años. Durante este tipo de periodos en la historia de nuestro planeta, la materia orgánica contenida en los organismos “retiene” el isótopo estable más ligero del carbono (12C, en negro), en tanto que el 13C (en rojo), si bien es también utilizado lo es en menor proporción, por lo que queda remanente en la fracción inorgánica (rocas, por ejemplo).
- Nuestro planeta durante una época con baja productividad biológica, como podría ser durante una extinción masiva. La cantidad de organismos vivos es menor, por lo que todo el 12C que sería “retenido” por ellos pasa a formar parte de las rocas, junto con el 13C. Esto representa que este último se encuentre empobrecido en las rocas con respecto al 12C.
*Imágenes ilustrativas. Ni el tamaño de los átomos, la cantidad de los mismos, ni la magnitud de la evaporación o de otros fenómenos se encuentran a escala.
El doctor Francisco Sánchez-Beristain es investigador de la Unidad Multidisciplinaria de Docencia e Investigación de la Facultad de Ciencias de la Universidad Nacional Autónoma de México, Campus Juriquilla
AQUÍ PUEDES LEER TODAS LAS ENTREGAS DE “DESDE LA UNAM”, LA COLUMNA DE LA UNAM CAMPUS JURIQUILLA PARA LALUPA.MX
https://lalupa.mx/category/aula-magna/desde-la-unam/